JSER Policies
JSER Online
JSER Data
Frequency: quarterly
ISSN: 1409-6099 (Print)
ISSN: 1857-663X (Online)
Authors Info
- Read: 39536
|
ПОДИГАЊЕ НА C-РЕАКТИВЕН ПРОТЕИН НА СЕРУМОТ И S100 ПРОТЕИНИ ЗА СИСТЕМСКОТО ВОСПАЛЕНИЕ КАЈ ДЕЦАТА СО АУТИЗАМ Вијендра К. СИНГ
Институт за Биологија, Државен Универзитет во Јута, Логан, САД |
|
ELEVATION OF SERUM C-REACTIVE PROTEIN AND S100 PROTEINS FOR SYSTEMIC INFLAMMATION IN AUTISTIC CHILDREN Vijendra K. SINGH
Department of Biology, Utah State University, Logan, USA |
|
Вовед |
|
Introduction |
|
Аутизмот сега општо е признат како биолошко нарушување на развојниот нервен систем (ЦНС). Тој не се идентификува со некоја специфична невропатологија или биомаркер туку главно со клиничка дијагноза што се потпира на различни невролошки и нарушувања во однесувањето, вклучувајќи дефицити на повисоки ментални функции како што се социјална интеракција, јазик, комуникација, имагинација и когниција. Постојат неколку хипотези, но причината за нарушувањето не е многу разјаснето. Меѓу придонесувачките фактори, имуните фактори како што се автоимунитетот, проинфламаторните и регулаторните цитокини можат да ја играат фундаменталната улога за патогенезата на аутизмот (1-8). Во сегашнава студија, серумскиот CRP и S100 протеини (и подвидовите алфа и бета) се профилирани кај децата со аутизам зашто тие се одговор на акутна фаза на прототипски реактанти и добро познати сурогатски маркери на системското воспаление (9-17). Како што е опишано во овој труд, децата со аутизам имаат повисоки од нормални нивоа на овие протеини во акутна фаза, што имплицира можно инволвирање на системско инфламаторниот одговор кај аутизмот. |
|
Autism is now commonly recognized as a biological disorder of the developing central nervous system (CNS). It is identified not by any specific neuropathology or biomarker but mainly by clinical diagnosis relying on various neurological and behavioral impairments, including deficits of higher mental functions such as social interaction, language, communication, imagination and cognition. There are several hypotheses but the cause of the disorder is not very well understood. Among contributing factors, the immune factors such as autoimmunity, pro-inflammatory and regulatory cytokines might play a fundamental role in the pathogenesis of autism (1-8). In the present study, serum CRP and S100 proteins (both the alpha- and beta- subtypes) were profiled in autistic children because they are the prototypic acute-phase response reactants and well-known surrogate markers of systemic inflammation (9-17). As described in this paper, autistic children had higher than normal levels of these acute-phase proteins, which imply possible involvement of a systemic inflammatory response in autism. |
|
|
|
|
|
Материјали и методи |
|
Materials and Methods |
|
Студијата вклучува вкупно 82 деца: 41 дете со аутизам (средна возраст 6.7 години; 34 машки и 7 женски) и 41 нормално дете (средна возраст 7.4 години; 25 машки и 16 женски). Децата со аутизам во оваа студија имаат цврста дијагноза на аутизам но студијата ги исклучува другите дијагнози како што се первазивната развојна неспособност - не поинаку специфицирана (PDD-NOS), Аспергеровиот синдром, Дауновиот синдром или идиопатска ментална ретардација [1-5]. Клиничката дијагноза на аутизмот беше главно утврдена со помош на Прирачникот за дијагностички и статистички ментални нарушувања, четврто издание (DSM-IV). |
|
The study included a total of 82 children: 41 autistic children (mean age 6.7 yrs; 34 male and 7 female) and 41 normal children (mean age 7.4 yrs; 25 male and 16 female). Autistic children in this study had a firm diagnosis of autism but the study excluded other diagnoses such as the pervasive developmental disability-not otherwise specified (PDD-NOS), Asperger’s syndrome, Down’s syndrome or idiopathic mental retardation [1-5]. The clinical diagnosis of autism was established mainly by the Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition (DSM-IV). |
|
Нормалните деца се со цврсто физичко здравје без никаков знак на болест на мозокот или ментална болест или некоја друга позната ментална состојба. Колку што беше можно, субјектите се поврзуваа според возраста и полот. Меѓутоа, никој не беше одбиен да учествува заради раса, возраст или пол освен ако не беше во опсегот на нашето истражување. За да се почитува правилото за приватност од Законот за преносливост и одговорност на здравственото осигурување (HIPAA), добивме потребна дозвола од Институцискиот ревизорски одбор на Државниот универзитет во Јута и порано од Универзитетот во Мичиген. Во времето на собирање на крв, нормалните и децата со аутизам беа на нулта линија без никакви пропишани лекови и ниту едно немаше некаква историја на кардиоваскуларна болест. Сегашната студија ги користеше примероците од претходно собран серум кои беа зачувани замрзнати на –20oC без повторливи циклуси на смрзнување и топење (18-22). Хуманиот серумски CRP беше мерен со ELISA користејќи комерцијално купени опреми (Biomeda, Foster City, CA). Пробната процедура на CRP вклучувајќи ги податоците за интерпретација беше стриктно според инструкциите на производувачот на опремата. Нивото на серумот на S100-алфа и S100-бета протеини се мереше со методата ELISA како што претходно беше опишано (15). Примероците од серумот беа анализирани на „двојно слеп“ начин и шифрата беше отворена откако анализата беше комплетирана. Податоците беа дадени како средна вредност од групата ± стандардна грешка (S.E.) од средна вредност и статистичката важност (p≤0.05) беше евалуирана со тестовите на студенти. |
|
Normal children were those having a firm physical health without any sign of brain disease or mental illness or any other known medical condition. As far as possible, the subjects were matched for age and gender. However, no one was denied participation in the study because of the race, age or gender factors except those beyond the scope of our research. To comply with the Health Insurance Portability and Accountability Act (HIPAA) Privacy Rule, we obtained necessary permission of the Institutional Review Board (IRB) at Utah State University and formerly at the University of Michigan. At the time of blood collection, both the normal as well as the autistic children were at the baseline without any prescription medications and none had the history of any cardiovascular disease. The present study utilized previously collected serum samples that were preserved frozen at –20oC without repetitive cycles of freezing and thawing (18-22). Human serum CRP was measured by ELISA using the commercially bought kits (Biomeda, Foster City, CA). The CRP assay procedure including the data interpretation was strictly in compliance with the kit manufacturer’s instructions. The serum level of S100-alpha and S100-beta proteins was measured by ELISA method as described previously (15). Serum samples were analyzed in a double-blind fashion and the code was broken after the analysis has been completed. The data are given as the mean of the group ± standard error (S.E.) of the mean and the statistical significance (p≤0.05) was evaluated by the Student’s t test. |
|
|
|
|
|
Резултати и дискусија |
|
Results and Discussion |
|
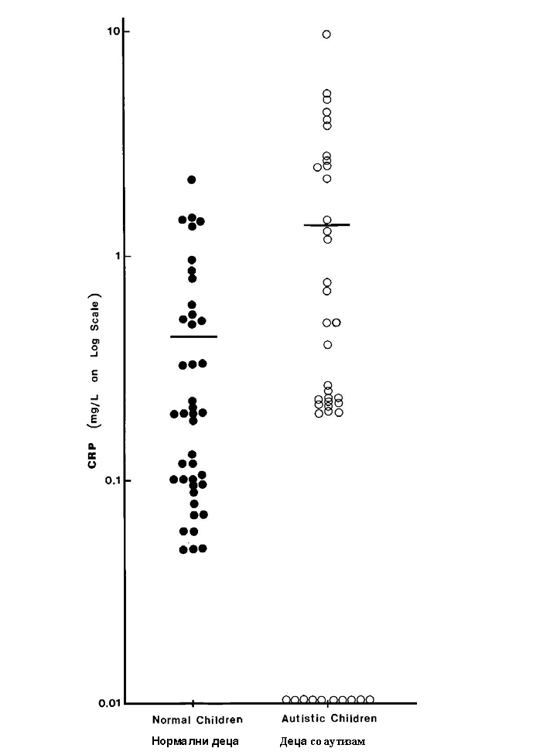
Експерименталните податоци за серумскиот CRP кај нормалните и децата со аутизам е прикажан на сл. 1. И двете групи имаа забележливи нивоа на CRP но околу една четвртина од децата со аутизам (10 од 41) имаа одвај забележливо количество на протеин. |
|
The experimental data for serum CRP in normal and autistic children are shown in Fig. 1. Both groups of children had detectable levels of CRP but about one-quarter of the autistic children (10 out of 41) had a barely detectable amount of this protein. |
|
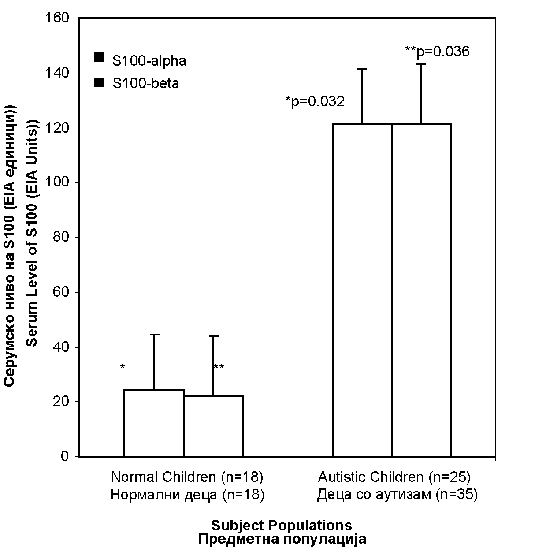
Слика 1. Дистрибуција на серумскиот CRP кај нормални и деца со аутизам. Левиот панел покажува податоци за нормални деца (солидни кругови) додека десниот панел покажува податоци за децата со аутизам(отворени кругови). Аритметичката средина за секоја група е прикажана со хоризонтална линија. Децата со аутизам(n=41) имаат значително (p=0.005) повисоко ниво на CRP отколку нормалните деца (n=41). Како група, децата со аутизам (1.373±0.318) имаа значително (p=0.005) повисоко ниво на CRP отколку нормалните деца (0.417±0.078). Ова значи дека имаше приближно 3.5-пати зголемување на CRP кај деца со аутизам. Податоците од лабораторијата за S100 протеини се опишани на слика 2. Нивото на подвидовите алфа и бета беше значително повисоко кај децата со аутизам споредено со нормалните деца (околу 6-пати зголемување; со p вредности 0.032 и 0.036 за S100-алфа и S100-бета посебно, со тестот за студенти). Највообичаено, индукцијата на имуно-посредни болести вклучува имуно-активирање како почетен настан. Така, имуно-активирањето е еден од примарните настани при воспаленијата, вирусните инфекции и автоимуните реакции. Имуно-активирањето обично се манифестира со спонтана акумулација на протеини во акутната фаза и про-инфламаторните цитокини во циркулација. CRP е класичен протеин во акутната фаза што брзо се акумулира во крвта во текот на инфламаторните одговори (9-11). Иако не е специфичен за некоја болест, овој протеин општо се смета како маркер-застапник на системското воспаление што ги придружува хроничните болести, посебно коронарно артериската болест (9-11). S100 протеинот, протеин за врзување на калциумот со афинитет за врзување на цинкот исто така, оригинално беше откриен во мозокот (12). Тој постои во два подвида, имено S100-алфа и S100-бета. Потоа, беше откриено дека протеинот има многу поширока распределба на ткивото, вклучувајќи го и серумот на крвта (15-17), периферни крвни мононуклеарни клетки (13) и антиген-презентирачки клетки (12, 13). Во последниве години, откриено е дека S100 протеинот на серумот исто така е реактант во акутна фаза за инфламаторните реакции, посебно кај повреда на мозокот и невролошките состојби како што се шизофренијата (16), Алцхајмеровата болест (14, 15), Дауновиот синдром (14) и СИДА деменција комплекс (17). |
|
Figure 1. Distribution of serum CRP in normal and autistic children. The left hand panel shows data points for normal children (solid circles) whereas the right hand panel shows data points for autistic children (open circles). The arithmetic mean for each group is shown by horizontal bar. Autistic children (n=41) had a significantly (p=0.005) higher level of CRP than the normal children (n=41).
As a group, autistic children (1.373±0.318) had a significantly (p=0.005) higher level of CRP than the normal children (0.417±0.078). This means that there was approximately 3.5-fold increase of CRP in children with autism. The laboratory data for S100 proteins are described in Figure 2. The level of both the alpha- and beta- subtypes was significantly higher in autistic children as compared to normal children (about 6-fold increase; p values being 0.032 and 0.036 for S100-alpha and S100-beta, respectively, by the Student’s t test). |
|
Слика 2.Дистрибуција на серумските S100 протеини кај нормални и деца со аутизам. Нивото на серумот на S100-алфа (темна боја) и S100-бета (светла боја) е прикажано за нормалните деца (левиот столб) и за децата со аутизам(десниот столб). Податоците се презентирани како аритметичка средина ± S.E. за секоја група. Децата со аутизам(n=25) имаа значително повисоко ниво на S100-алфа (p=0.032) и S100-бета (p=0.036) отколку нормалните деца (n=18). Бидејќи аутизмот исто така е нарушување на мозокот со невролошки дефицити и проинфламаторните цитокини се поврзани; ние го простудиравме S100 протеинот кај децата со аутизам. Како што е овде кажано, и двата подвида алфа и бета на S100 протеинот беа значително подигнати кај деца со аутизам, наод кој е прилично постојан со случајна улога на системското воспаление во ова нарушување на мозокот. Пред неколку години, ние први демонстриравме дека аутизмот инволвира имуни фактори како што се автоимунитетот (на пр. Специфичните автоантитела на мозокот) и проинфламаторните цитокини (на пр. интерферонот-γ и интерлеукинот-12) давајќи му предност на Th-1 имуниот одговор (1-3). Тоа н¡ доведе до претпоставка дека аутизмот инволвира имуно активирање на одговорот на инфламаторниот систем (2-4). Сега воспалението е исто така опсервирано од други истражувачи (23), иако овие истражувачи не ги цитираат нашите студии што многу порано ги објавивме (2, 24). Понатаму, како што е опишано во сегашнава студија, аутизмот веројатно може да инволвира системски инфламаторен одговор. Импулсивниот агент за овој инфламаторен одговор не е с¡ уште познат но може да резултира од имуното активирање од вирусна инфекција или микробска инфекција. И покрај тоа што оваа можност останува за испитување, постојат значителни лабораториски податоци и експериментална евиденција што го имплицира вирусот на мали сипаници во овој одговор (3, 18-20). Како што е изложено на друго место, добиената инфекција на мали сипаници од вакцината на мали сипаници-заушки-рубеола (MMR) може да го поттикне системскиот инфламаторен одговор (19-20), главно зашто овој вирус е познат поттикнувач на проинфламаторните цитокини (25) и покажа позитивна корелација со автоантителата на мозокот кај деца со аутизам (3, 18-20). Засега, меѓутоа, двата вида лабораториски студии не дадоа поддршка на улогата на тимеросалот во автоимуната подгрупа на аутизмот (21, 22). Понатаму, земајќи ја предвид опсервацијата дека статинската терапија ги намалува вредностите на CRP кај кардиоваскуларните пациенти (9-11), можеби повредно ќе биде дизајнирањето на добро контролирана студија за да се евалуира дали оваа терапија би можела потенцијално да биде корисна за да им помогне на пациентите со аутизам со подигнато ниво на CRP. Во заклучокот, базиран на некои согледувања од имунолошки студии и автоимунитетот на мозокот (1-8), предизвикувачки е да се шпекулира дека инфламаторниот одговор поттикнат од вирус би можел да биде одговорен за индукција на автоимунитетот кај аутизмот. Додека добиената инфекција од мали сипаници од MMR имунизација е добра можност, другите остануваат да се истражуваат. Во прилог на ова, внимателно дизајнираната основа и клиничките студии се оправдување за понатамошно идентификување и карактеризирање на улогата на системското воспаление кај патогенезата на аутизмот. |
|
Figure 2. Distribution of serum S100 proteins in normal and autistic children. The serum level of S100-alpha (dark color) and S100-beta (light color) is shown for normal children (left hand bars) and autistic children (right hand bars). Data are presented as the arithmetic mean ± S.E. for each group. Autistic children (n=25) had a significantly higher level of S100-alpha (p=0.032) and S100-beta (p=0.036) than the normal children (n=18).
Since autism is also a brain disorder with neurological deficits and pro-inflammatory cytokines have been linked, we studied S100 protein in autistic children. As reported here, both the alpha- and beta- subtypes of S100 protein were significantly elevated in children with autism, a finding that is quite consistent with the causal role of systemic inflammation in this brain disorder. |
|
|
|
|
|
Признание |
|
Acknowledgments |
|
Огромно признание за огромната поддршка на проектот Автоимунитетот кај аутизмот, Институтот за истражување на аутизам и Фондацијата Dudley T. Dougherty. |
|
The grant support of The Autism Autoimmunity Project, Autism Research Institute and Dudley T. Dougherty Foundation is gratefully acknowledged. |
|
Citation:Singh KV. Elevation of Serum C-Reactive Protein and S100 Proteins for Systemic Inflammation in Autistic Children. J Spec Educ Rehab 2005; 6(3-4):117-135. |
||||
|
|
||||
|
Литература / References |
|
|
||
|
|
|
||
|
Адреса за сепаратите: |
|
Address requests for reprint to: |
|
Вијендра СИНГ |
|
Vijendra SINGH |
|
914 Sudden Valley |
|
914 Sudden Valley |
Share Us
Journal metrics
-
 SNIP 0.059
SNIP 0.059 -
 IPP 0.07
IPP 0.07 -
 SJR 0.13
SJR 0.13 -
 h5-index 7
h5-index 7 -
 Google-based impact factor: 0.68
Google-based impact factor: 0.68
10 Most Read Articles
- PARENTAL ACCEPTANCE / REJECTION AND EMOTIONAL INTELLIGENCE AMONG ADOLESCENTS WITH AND WITHOUT DELINQUENT BEHAVIOR
- RELATIONSHIP BETWEEN LIFE BUILDING SKILLS AND SOCIAL ADJUSTMENT OF STUDENTS WITH HEARING IMPAIRMENT: IMPLICATIONS FOR COUNSELING
- EXPERIENCES FROM THE EDUCATIONAL SYSTEM – NARRATIVES OF PARENTS WITH CHILDREN WITH DISABILITIES IN CROATIA
- INOVATIONS IN THERAPY OF AUTISM
- AUTISM AND TUBEROUS SCLEROSIS
- THE DURATION AND PHASES OF QUALITATIVE RESEARCH
- REHABILITATION OF PERSONS WITH CEREBRAL PALSY
- DISORDERED ATTENTION AS NEUROPSYCHOLOGICAL COGNITIVE DISFUNCTION
- HYPERACTIVE CHILD`S DISTURBED ATTENTION AS THE MOST COMMON CAUSE FOR LIGHT FORMS OF MENTAL DEFICIENCY
- DIAGNOSTIC AND TREATMENT OPTIONS IN AUTISTIC SPECTRUM DISORDERS – AN OVERVIEW
















