JSER Policies
JSER Online
JSER Data
Frequency: quarterly
ISSN: 1409-6099 (Print)
ISSN: 1857-663X (Online)
Authors Info
- Read: 46434
|
ВОСПОСТАВУВАЊЕ НА ПАРАОКСОНАЗНАТА И АРИЛЕСТЕРАЗНАТА АКТИВНОСТ НА ПАРАОКСОНАЗА 1 (ПОН1) ВО ЗАВИСНОСТ ОД 55 (L/M) И 192 (Q/R) ДНК ПОЛИМОРФИЗАМ КАЈ ВОЗРАСНИТЕ ЛИЦА СО ДАУНОВ СИНДРОМ
Павел СИКОРА1,
Институт за медицинска биологија, генетика и клиничка генетика, Медицински факултет Коменски универзитет, |
|
ESTABLISHMENT OF PARAOXONASE AND ARYLESTERASE ACTIVITY OF PARAOXONASE 1 (PON1) IN DEPENDENCE ON 55(L/M) AND 192(Q/R) DNA POLYMORPHISM IN ADULT PEOPLE WITH DOWN SYNDROME
Pavel SÝKORA1,
Institute of medical biology, genetic and clinical genetics, Faculty of Medicine Comenius University, |
|
Примено: 12. 10. 2009 |
|
Received: 12. 10. 2009 |
|
|
|
|
|
Вовед |
|
Introduction |
|
|
|
|
|
Хуманиот серум параоксоназа 1 (ПОН1; ЕЦ 3.1.8.1) е калциум зависна естераза кој припаѓа на липопротеини со висока густина (HDL) (1). Таа хидролизира и инактивира многу органофосфати (ОФ) како што се параоксон, инсектицидите паратион и хлорпирифос, и нервните гасови самон и сарин. Лактоназата може да ги хидролизира дихидрокумаринот, хомоцистеинлактат и други лактати. Важен ефект на ПОН1 е инхибицијата на ЛДЛ пероксидацијата и хидролизата на оксидативните форми на фосфолипидите. Затоа, ПОН1 значително влијае врз развојот на атеросклерозата (2). Антиaтерoгенетскиот ефект беше потврден од страна на многу епигенетски, генетски и биохемиски студии, кои врз основа на експерименти со глувци забележале дека нема присуство на ПОН1 генот, дека гореспоменатите заштитни влијанија се состојат од можноста на ПОН1 да ја намали оксидативната модификација на липопротеинските честички (1-3). |
|
Human serum paraoxonase 1 (PON1; EC 3.1.8.1) is a calcium-dependent esterase located on high density lipoproteins (HDL) (1). It hydrolyses and inactivates many organophosphates (OP) such as paraoxon, the insecticides parathion and chlorpyrifos, and the nerve gases soman and sarin. It acts as a lactonase, being able to hydrolyse dihydrocumarin, homocysteinthiolactone and other lactones. An important effect of PON1 is the inhibition of LDL peroxidation and hydrolysis of oxide forms of phospholipides. Therefore, PON1 significantly affects the development of aterosclerosis (2). Its antiatherogenetic effect was confirmed by many epigenetic, genetic and biochemic studies based on experiments with knockout mice lacking PON1 which supposed that the protective influence mentioned above consists of PON1 ability to decrease oxidative modification of lipoprotein particles (1-3). |
|
|
|
|
|
Материјали и методи |
|
Materials and methods |
|
|
|
|
|
Примероците на вкупната количина на крв (2,5 ml) и на серумот (1 ml) беа добиени од пациентите со Даунов синдром од клиничката канцеларија на СЗУ во Братислава. Групата на лица со ДС се состоеше од мажи (n=10) и жени (n=10) на возраст од 16 до 37 годишна возраст. Контролната група (10 мажи и 10 жени) главно се состоеше од нивните браќа и сестри кои беа приближно на иста возраст. Примените примероци беа складирани во оптимални услови се до нивната следна примена (2,5мл EDTA крв на -25°C и крвниот серум на -80°C).
|
|
All (whole) blood (2.5 ml) and serum (1 ml) samples were obtained from patients from Down syndrome program clinical office SZU, Bratislava. The group with DS consisted of men (n=10) and women (n=10) aged 16 to 37. The control group (10 men and 10 women) primarily consisted of their siblings of approximately the same age. Acquired samples were stored in optimal conditions until next utilization (2.5 ml EDTA blood at -25°C and blood serum at -80°C). |
|
Табела 1. ДНК протокол за анализа |
|
Table 1. DNA analysis protocol |
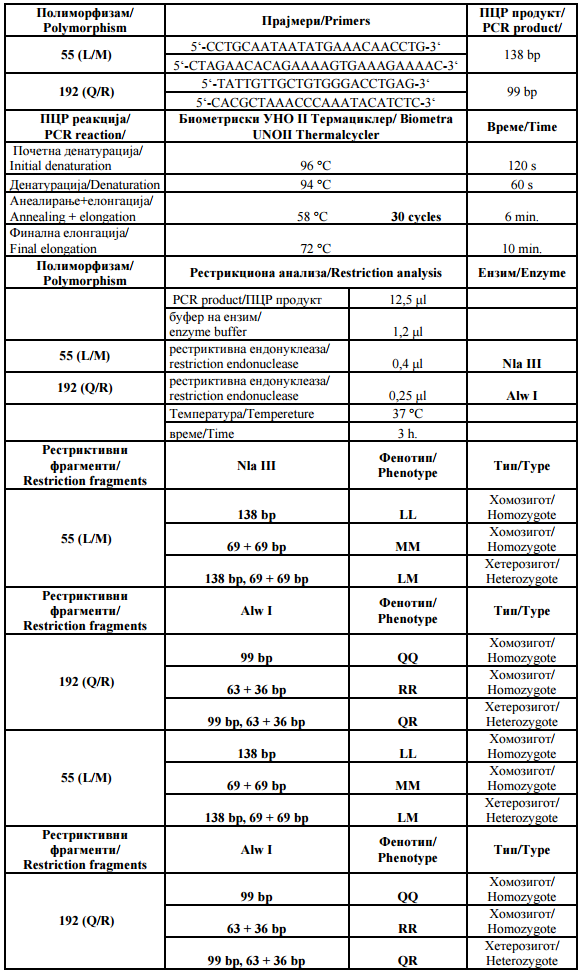
|
Вредностите за апсорпција беа забележани за 3 минути. Тоа беше во времетраење од додавањето на супстратот до појавата на реакцијата. |
|
The absorbance values were recorded within 3 minutes from the addition of the substrate to the reaction blend. |
|
Резултати |
|
Results |
|
|
|
|
|
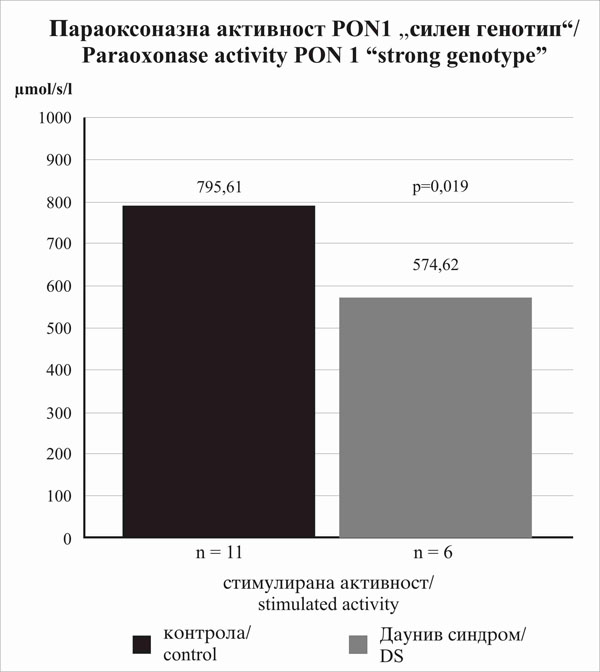
Забележавме значително намалување на стимулираната параоксоназна активност (p=0,019; сл.1) кај субјектите со ДС (n=6) во споредба со контролната група (n=11) во првата група (RR//LL или QR/LL). Вредностите на нестимулираните параоксоназни и арилестеразни активности, исто така беа пониски за лицата со ДС, меѓутоа намалувањето не беше значително (p>0,05). |
|
We have observed a significant decrease of stimulated paraoxonase activity (p=0.019; fig.1) in subjects with DS (n=6) in comparison to the control group (n=11) in the first group (RR//LL or QR/LL). The values of non-stimulated paraoxonase and arylesterase activities were lower for subjects with DS as well, but the decrease was not of any significance (p>0.05). |
|
Слика 1.Значително намалување на стимулираната параоксиназна активност кај субјекти со ДС |
|
Figure 1. Significantly decreased stimulated paraoxonase activity in subjects with DS |
|
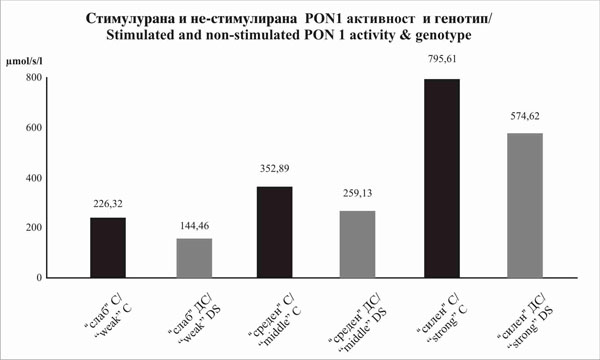
Слика 2.Споредба на стимулираната и нестимулираната параоксоназна активност во сите групи на генотипи |
|
Figure 2. Comparison of stimulated and non-stimulated paraoxonase activity in all genotype groups |
|
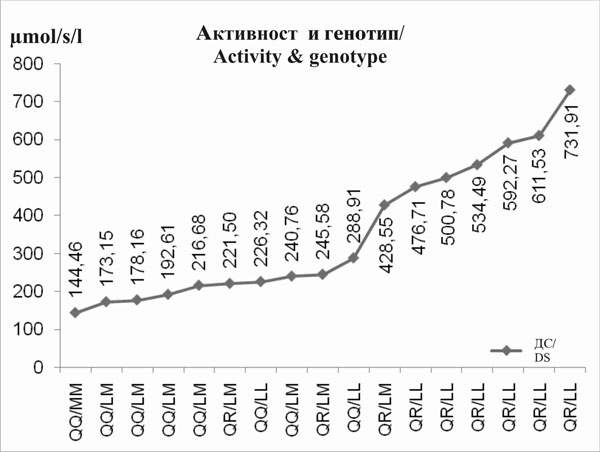
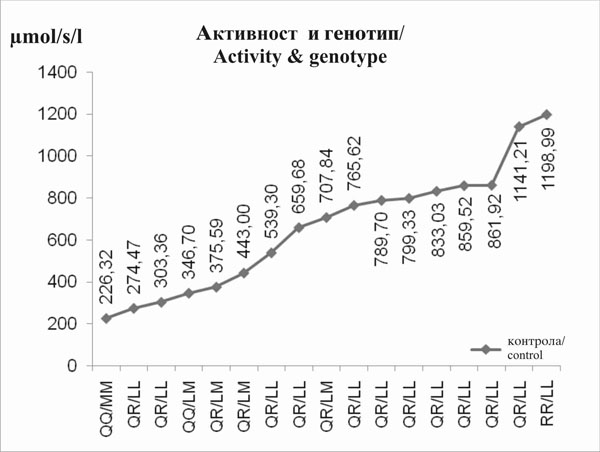
Го воочивме влијанието на 55(L/M) и 192(Q/R) ПОН1 полиморфизмот врз активноста на ПОН1. Забележавме прогресивна тенденција на активноста на параоксоназата која кореспондира со овој распоред на ПОН1 полиморфизмот QQ/MM < QQ/LM < QR/LM < QR/LL < RR/LL (сл. 3 и 4). Влијанието на активноста на арилестеразата не може да биде јасно демонстрирана. |
|
We found the influence of 55(L/M) and 192(Q/R) PON1 polymorphism on PON1 activity. We noticed a progressive tendency of paraoxonase activity corresponding to this PON1’s polymorphism order QQ/MM < QQ/LM < QR/LM < QR/LL < RR/LL (fig. 3 and 4). The influence on arylesterase activity could not be clearly demonstrated. |
|
Слика 3.Прогресивен тренд на стимулирана параоксоназна активност соодветно на генотипот (ПОН1 полиморфизам) кај субјекти со ДС |
|
Figure 3. Progressive trend of stimulated paraoxonase activity with regard to genotype (PON1 polymorphism) in subjects with DS |
|
Слика 4.Прогресивен тренд на стимулирана активност на параоксоназата соодветно на генотипот (ПОН1 полиморфизам) во контролната група |
|
Figure 4. Progressive trend of stimulated paraoxonase activity with regard to genotype (PON1 polymorphism) in control group |
|
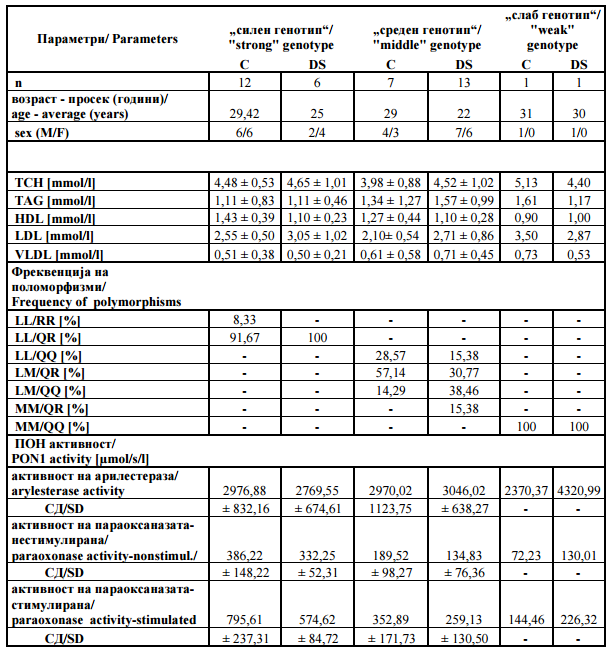
Табела 2. Резултати и карактеристики на генотипните групи |
|
Table 2. Results and genotype groups‘s characteristic |
|
Заклучокот од претходно изнесените податоци, е дека ДНК анализите и резултатите од спектрометријата индицираат поврзаност меѓу активноста на ПОН1 и параметрите за липидниот профил. Не забележавме поврзаност меѓу активноста на ПОН1 и параметрите како тотален холестерол, TAG, HDL, LDL и VLDL. |
|
To conclude, the DNA analysis and spectrophotometry results indicate an association between PON1 activity and lipid profile’s parameters. We did not observe any connection between PON1 activity and parameters such as total cholesterol, TAG, HDL, LDL and VLDL. |
||
|
|
|
|
||
|
Дискусија |
|
Discussion |
||
|
|
|
|
||
|
Постојат различни мислења за регулацијата на експресијата на ПОН1 генот кај пациентите со ДС. Џанел и сор. укажуваат на зголемена експресија на ПОН1 генот во црнодробните клетки на фетусите со ДС. Дополнително, тие нашле редуцирана експресија на генот ПОН1 во црниот дроб на глувци со дефицит на цистатионин-бета синтетазата (ЦБС), модел на хиперхомоцистеинемија, чија клиничка слика е асоцирана со зголемен ризик од атеросклероза (13). Откако ЦБС генот е лоциран на хромозомот 21, тие предлагаат дека зголемената „генетска доза“ на ЦБС може да иницира горна регулирана експресија на ПОН1 генот кај субјекти со ДС. Од друга страна, некои студии потврдуваат дека регулацијата на експресијата на ПОН1 генот е долно регулирана од оксидативен стрес (2, 14). |
|
There are different opinions on the regulation of PON1 gene expression in patients with DS. Janel et al. reports increased PON1 gene expression in hepatic cells of fetuses with DS. In addition, they found reduced gene expression of PON1 in liver of cystathionine-beta synthetase (CBS) deficient mice, a murine model of hyperhomocysteinemia, clinical picture of which is associated with an increased risk of atherosclerosis (13). Since the CBS gene is located on chromosome 21, they propose that increased „genetic dose“ of CBS can initiate up-regulated PON1 gene expression in subjects with DS. On the other hand, some studies affirm that the regulation of PON1 gene expression is down-regulated by oxidative stress (2, 14). |
||
|
|
|
|
||
|
Citation:Sýkora P, Repiská V, Shustrová M, Halchák L. Establishment of Paraoxonase and Arylesterase Activity of Paraoxonase 1 (Pon1) in Dependence On 55(L/M) and 192(Q/R) DNA Polymorphism in Adult People with Down Syndrome. J Spec Educ Rehab 2010; 11(1-2):103-113. |
||||
|
|
||||
|
Литература / References |
|
|
||
|
|
|
||
Share Us
Journal metrics
-
 SNIP 0.059
SNIP 0.059 -
 IPP 0.07
IPP 0.07 -
 SJR 0.13
SJR 0.13 -
 h5-index 7
h5-index 7 -
 Google-based impact factor: 0.68
Google-based impact factor: 0.68
10 Most Read Articles
- PARENTAL ACCEPTANCE / REJECTION AND EMOTIONAL INTELLIGENCE AMONG ADOLESCENTS WITH AND WITHOUT DELINQUENT BEHAVIOR
- RELATIONSHIP BETWEEN LIFE BUILDING SKILLS AND SOCIAL ADJUSTMENT OF STUDENTS WITH HEARING IMPAIRMENT: IMPLICATIONS FOR COUNSELING
- EXPERIENCES FROM THE EDUCATIONAL SYSTEM – NARRATIVES OF PARENTS WITH CHILDREN WITH DISABILITIES IN CROATIA
- INOVATIONS IN THERAPY OF AUTISM
- AUTISM AND TUBEROUS SCLEROSIS
- THE DURATION AND PHASES OF QUALITATIVE RESEARCH
- REHABILITATION OF PERSONS WITH CEREBRAL PALSY
- DISORDERED ATTENTION AS NEUROPSYCHOLOGICAL COGNITIVE DISFUNCTION
- HYPERACTIVE CHILD`S DISTURBED ATTENTION AS THE MOST COMMON CAUSE FOR LIGHT FORMS OF MENTAL DEFICIENCY
- DIAGNOSTIC AND TREATMENT OPTIONS IN AUTISTIC SPECTRUM DISORDERS – AN OVERVIEW
















