JSER Policies
JSER Online
JSER Data
Frequency: quarterly
ISSN: 1409-6099 (Print)
ISSN: 1857-663X (Online)
Authors Info
- Read: 45176
|
АНАЛИЗА НА СЕРУМОТ НА АМИЛОИД-БЕТА ПРОТЕИН1-40 КАЈ ЗДРАВИ СУБЈЕКТИ, ДЕЦА СО АУТИЗАМ И ПАЦИЕНТИ СО АЛЦХАЈМЕРОВА БОЛЕСТ
Вијендра К. СИНГ
Оддел за биологија, Државен универзитет на Јута, (САД) |
|
SERUM ANALYSIS OF AMYLOID BETA-PROTEIN 1-40 IN HEALTHY SUBJECTS, AUTISTIC CHILDREN AND ALZHEIMER’S PATIENTS
Vijendra K. SINGH
Department of Biology, Utah State University, Logan, Utah (USA) |
|
|
|
UDK: 616.89:616.153.96-053.2 |
|
|
|
|
|
|
|
|
|
Вовед |
|
Introduction |
|
Акумулација на АП40 се јавува во мозокот во текот на нормалното стареење но неговата количина е зголемена во мозокот на пациентите со Алцхајмерова болест (1). Во однос на мозокот, АП40 се локализира надвор од мозокот на кожните фибробласти и био-лошките течности, вклучувајќи го и крвниот серум. Добро е познато дека АП40 покажува и невротрофички и невротоксички ефекти (2-4), вклучувајќи неврогенско делување врз стеблото на нервните клетки (5). Земајќи ги предвид овие својства, претпоставуваме дека АП40 може да игра патогенетска улога кај аутизмот. |
|
Accumulation of AP40 occurs in the brain during normal aging but its amount is increased in the brain of patients with Alzheimer’s disease (1). In addition to brain, AP40 has been localized outside the brain in skin fibroblasts and biological fluids, including the blood serum. AP40 is well known to exhibit both neurotrophic and neurotoxic effects (2-4), including neurogenic action on neural stem cells (5). Considering these properties, we hypothesized that AP40 might play a pathogenic role in autism. |
|
Сегашната студија ги опишува резултатите од лабораториската анализа на серумот АП40, кој откривме дека се намалува во текот на нормалното стареење, кај децата со аутизам и пациентите со Алцхајмерова болест. Прелиминарните наоди на оваа студија беа презентирани на друго место (11). |
|
The present study describes results of laboratory analysis of serum AP40, which was found to decline during normal aging, autistic children and Alzheimer’s patients. Preliminary findings of this study were presented elsewhere (11). |
|
|
|
|
|
Човечки субјекти и методи |
|
Human Subjects and Methods |
|
Студијата вклучи 53 нормални деца (на возраст од 3-13 години), 9 нормални возрасни (25-40 години), 9 нормални контролни лица (50-80 години), 53 деца со аутизам (4-12 години) и 21 пациент со Алцхајмерова болест (60-82 години). Клиничката дијагноза кај аутизмот беше направена во основа според стандардните DSM-IV критериуми на Американската асоцијација на педијатри, Вашингтон, ДиСи. Невролозите направија клиничка дијагноза на Алцхајмеровата болест (АБ) според критериумите на NINCDS-ADRDA, која исто така вклучи едно испитување на „мини-ментална состојба“ и двегодишен опаѓачки тек на прогресијата на болеста. IRB на Универзитетот на државата Јута и Универзитетот на Мичиген го оценија и одобрија протоколот на нашето истражување, кое вклучи и користење на примероци на човечка крв (6-8). Сите субјекти беа на основната линија без никаков третман со препишени медикаменти во време на собирањето на крвта или барем 2 недели претходно од третманот. Сите примероци на серум претходно беа собрани како дел на тековната студија за автоимунитетот при нарушувања на ЦНС и се чуваа замрзнати на околу -20oC. |
|
The study included 53 normal children (age 3-13 yrs), 9 normal adults (age 25-40 yrs), 9 normal aged controls (age 50-80 yrs), 53 autistic children (age 4-12 yrs) and 21 Alzheimer’s disease patients (age 60-82 yrs). The clinical diagnosis of autism was made essentially according to the standard DSM-IV criteria of the American Association of Psychiatrists, Washington, DC. Neurologists made the clinical diagnosis of Alzheimer’s disease (AD) according to the NINCDS-ADRDA criteria, which also included a ‘Mini-Mental State’ examination and a two-year downward course of the disease progression. The IRB of Utah State University and the University of Michigan reviewed and approved our research protocol involving the use of human blood samples (6-8). All subjects were at the baseline without any treatment with prescription medications at the time of blood collection or at least two weeks prior to it. All serum samples were previously collected as part of our ongoing study of autoimmunity in CNS disorders and they were stored frozen at about -20oC. |
|
Резултати и дискусија |
|
Results and Discussion |
|
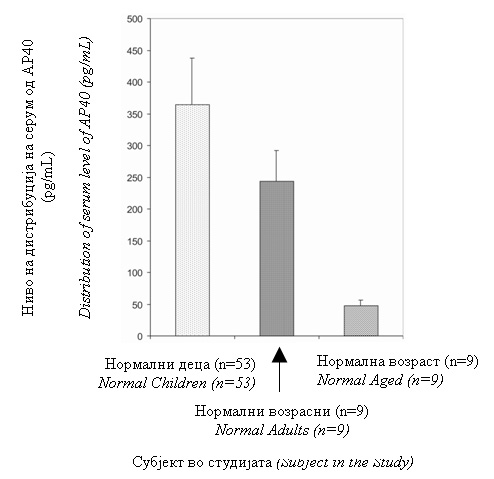
Нормалните деца имаа значително повисоко ниво на АП40 споредено со нормалното стареење на индивидуите (Слика 1). |
|
Normal children had a significantly higher level of AP40 compared to the normal aged individuals (Figure 1). |
|
Слика 1. Дистрибуцијата на серумот АП40 како функција на нормалното стареење. Левата вертикална колона ги прикажува податоците за нормалните деца, средната колона за нормалните возрасни и десната колона за индивдуите што стареат. Аритметичката средина ±S.E. е прикажана за секоја група. Нормалните деца имаа значително повисока вредност споредена со нормалните индивидуи што стареат (p=0.000). Нивото на АП40 кај нормалните возрасни беше поблиску до нивото на нормалните деца но повисоко од нормалното стареење на субјектите. Децата со аутизам задржаа значително пониско ниво на АП40 од нормалните деца (Слика 2). |
|
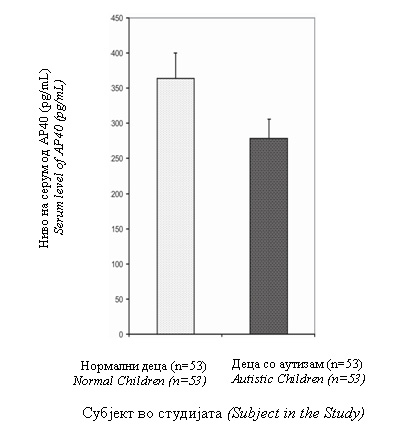
Figure 1. Distribution of serum AP40 as a function of normal aging. The left hand vertical column shows data for normal children, middle column for normal adults and the right hand column for aged individuals. The arithmetic mean ± S.E. is depicted for each group. Normal children had a significantly higher value as compared to normal aged individuals (p=0.000). The level of AP40 in normal adults was closer to the level in normal children but higher than the normal aged subjects. Autistic children harbored a significantly lower level of AP40 than the normal children (Figure 2). |
|
Слика 2.Ниво на серум на АП40 кај нормални деца и деца со аутизам. Левата вертикална колона ги прикажува податоците за нормалните деца а десната колона за децата со аутизам. Аритметичката средина ±S.E. е прикажана за секоја група. Децата со аутизам имаа значително пониска вредност споредена со нормaлните деца (p=0.034). |
|
Figure 2. Serum level of AP40 in Normal Children and Autistic Children. The left hand vertical column shows data for normal children and the right hand column for autistic children. The arithmetic mean ± S.E. is depicted for each group. Autistic children had a significantly lower value as compared to normal children (p=0.034). |
|
Децата со аутизам имаа значително повисоко ниво на АП40 од пациентите со Алцхајмерова болест. Така откривме дака нивото на серумот АП40 опаѓа со стареењето кај здравите индивидуи. Нормалните деца имаа највисоко ниво, но нивото беше намалено кај децата со аутизам, што сугерираше за улогата на овој невропептид кај невропатологијата на аутизмот. Акумулација на АП40 во мозокот се јавува природно како функција на нормалното стареење, меѓутоа, неговото количество драматично се намалува во мозокот кај пациентите со Алцхајмерова болест (1, 2). И покрај екстензивните испитувања, улогата на пептидот сè уште останува контроверзна кај Алцхајмеровата болест. Не е познато дали тој е причина за болеста или едноставно е нуспроизвод на болеста. Во однос на мозокот, АП40 се јавува природно во крвниот серум/плазма, цереброспиналната тeчност, кожните фибробласти и други клетки на цицачи (1-4). Присуството на АП40 во биолошките течности сугерираше дека овој пептид се произведува во текот на нормалниот метаболизам на клетката најверојатно имајќи физиолошка функција низ животот. Навистина, АП40 ги покажува двојните дејствија, т.е. невротрофичкиот ефект на пониски концентрации (помалку од 5-10 micromolar) и невротоксичкиот ефект на повисоки концентрации (поголеми од 15-20 micromolar) (1-5). Кон тоа, ние претходно покажавме дека АП40 предизвикува пролиферација на периферните крвни мононуклеарни клетки (ПКМНК) (фракција на бели крвни клетки кои содржат лимфоцити и моноцити) на нормалните човечки субјекти, но ПКМНК на пациентите со Алцхајмерова болест не реагираа на АП40 во функционалната анализа (3). Ова беше единствената карактеристика што би можело потенцијално да се разликува меѓу нормалното стареење и Алцхајмеровата болест. Понатаму, ние известивме дека АП40 предизвикува пролиферација на мозочните клетки во примарните култури на клетките (4). Овој ефект беше со дополнување на супстанцата P во културите на мозочните клетки и посредуваше виа протеинската киназа C (ПКЦ), патека на клеточното сигнализирање (4).
Тие наоди идентификуваа еден клеточна пролиферација или невротофично дејство за АП40, кое неодамна покажа дека се поврзува со неврогенскиот ефект на АП40 на стеблото на нервните клетки (5). |
|
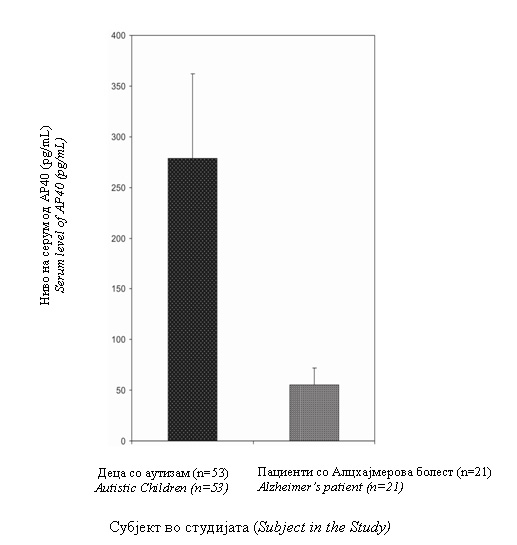
Autistic children had a significantly higher level of AP40 than the Alzheimer’s disease patients.
Thus we found that the serum level of AP40 decreased with aging in healthy individuals. Normal children had the highest level but the level was reduced in autistic children, suggesting a role for this neuropeptide in the neuropathology of autism.
These findings identified a cell proliferative or neurotrophic action for AP40, which has recently shown to be associated with the neurogenic effect of AP40 on neural stem cells (5). |
|
Citation:Singh KV. Serum Analysis of Amyloid Beta-Protein 1-40 in Healthy Subjects, Autistic Children and Alzheimer’s Patients. J Spec Educ Rehab 2008; 9(1-2):93-99. |
||||
|
|
||||
|
Литература / References |
|
|
||
|
|
|
||
Share Us
Journal metrics
-
 SNIP 0.059
SNIP 0.059 -
 IPP 0.07
IPP 0.07 -
 SJR 0.13
SJR 0.13 -
 h5-index 7
h5-index 7 -
 Google-based impact factor: 0.68
Google-based impact factor: 0.68
10 Most Read Articles
- PARENTAL ACCEPTANCE / REJECTION AND EMOTIONAL INTELLIGENCE AMONG ADOLESCENTS WITH AND WITHOUT DELINQUENT BEHAVIOR
- RELATIONSHIP BETWEEN LIFE BUILDING SKILLS AND SOCIAL ADJUSTMENT OF STUDENTS WITH HEARING IMPAIRMENT: IMPLICATIONS FOR COUNSELING
- EXPERIENCES FROM THE EDUCATIONAL SYSTEM – NARRATIVES OF PARENTS WITH CHILDREN WITH DISABILITIES IN CROATIA
- INOVATIONS IN THERAPY OF AUTISM
- AUTISM AND TUBEROUS SCLEROSIS
- DIAGNOSTIC AND TREATMENT OPTIONS IN AUTISTIC SPECTRUM DISORDERS – AN OVERVIEW
- THE DURATION AND PHASES OF QUALITATIVE RESEARCH
- REHABILITATION OF PERSONS WITH CEREBRAL PALSY
- DISORDERED ATTENTION AS NEUROPSYCHOLOGICAL COGNITIVE DISFUNCTION
- HYPERACTIVE CHILD`S DISTURBED ATTENTION AS THE MOST COMMON CAUSE FOR LIGHT FORMS OF MENTAL DEFICIENCY
















