JSER Policies
JSER Online
JSER Data
Frequency: quarterly
ISSN: 1409-6099 (Print)
ISSN: 1857-663X (Online)
Authors Info
- Read: 61858
|
Невропатологија на аутизам:
Мануел Ф. КАЗАНОВА1, Меган МОТ1 |
|
The Neuropathology of Autism:
Manuel F. CASANOVA1, Meghan MOTT1
1Department of Psychiatry and Behavioral Sciences |
|
|
|
|
|
Вовед |
|
Introduction |
|
Аутизмот е силно развојно нарушување чии причини и третман остануваат контроверзни. Додека патогенезата на аутизмот останува нејасна, наследноста од >90% сугерира мултигенска основа за оваа состојба (1). Канер е првиот кој го опиша аутизмот во 1943 кога проучува група деца кои покажуваа симптоми како што се социјалното нарушување, опсесивните повторливи однесувања, лингвистичките дефицити и нарушените когнитивни вештини (2). Неколку од овие испитаници покажаа исклучителни таленти, сепак задржувајќи ја оваа општофункционална попреченост. Актуелните DSM дијагностички критериуми за аутистичко нарушување ја вклучуваат манифестацијата на дијагностичките карактеристики пред 3-годишна возраст, специфицирана како задоцнето или абнормално функционирање или во социјалната интеракција, јазикот при комуникацијата или во симболичната / имагинативна игра (3). Не постои специфична мостра за дијагноза на ова нарушување и не постои јасна идентификација во радиолошките студии или EEG. Значителна коморбидност постои меѓу аутизмот, менталната ретардација (~70%) и епилепсијата (~40%) (4, 5). |
|
Autism is a pervasive developmental disorder whose causes and treatment remain controversial. While the pathogenesis of Autism remains obscure, a heritability of >90% suggests a multigenic basis for this condition (1). Kanner was the first to describe autism in 1943 when he studied a group of children that displayed symptoms such as social impairment, obsessive and repetitive behaviors, linguistic deficits and impaired cognitive skills (2). A few of these subjects showed exceptional talents while maintaining this general functional disability. The current DSM diagnostic criteria for “Autistic Disorder” include manifestation of diagnostic features prior to age 3, specified as delayed or abnormal functioning in either social interaction, language in communication or symbolic / imaginative play (3). There is no specific pattern for diagnosis of this disorder and no clear identification exists in imaging or EEG studies. Significant comorbidities exist between autism, mental retardation (~70%) and epilepsy (~40%) (4, 5). Rates of autistic disorder are 4 to 5 times higher in males than in females and epidemiological studies indicate an increase in the prevalence of autism over the last few decades. By some estimates, autism affects as many as 1 in 300 children (6, 7). While all autistics exhibit social deficiencies, the disorder has a wide range in the severity and pattern of cognitive impairment. According to this criterion, there are two diagnostic subcategories of autism: low-functioning autism with mental retardation (LFA) and high-functioning autism with normal intelligence (HFA). The distinction between HFA and Asperger syndrome is controversial (8, 9, 10). There has yet to be established a clear neuropathology for autism disorder. This is partially attributable to a lack of consistency among findings. Multiple factors account for such inconsistencies, notably conflicting subject diagnostic and exclusionary criteria. Statistical problems exist with the data collected on autism thus far, mainly due to small sample size, confounding factors such as comorbidity with other disorders, IQ and medication history. However, it is clear that characteristic neuropathologies are associated with the core symptoms of the disease. Five neuropathological features, in particular, are associated with autistic disorder: increased brain weight and white matter volume during childhood, reduced neuronal size and increased cell packing density in the forebrain limbic system, reduced numbers of Purkinje cells in the cerebellum, age-related changes in cell size and numbers in the nucleus of the diagonal band of Broca, deep cerebellar nuclei and inferior olive, and malformations of cerebral cortex and brainstem (11). This article reviews selected neuropathological studies of autism and discusses possibilities for future research suggested by their findings. |
|
Студиите за мозоците кај пациентите со аутизам споредени со незаболените контролни мозоци според возраста и полот откриваат дека мозоците на деца на возраст од 5-13 се значително потешки отколку контролните, додека мозоците на возрасни од 18-54 се значително полесни (11). Иако при раѓање обемот на главата, тежината на мозокот и волуменот изгледаат нормални, нападот врз макроцефалијата и макроенцефалијата почнува наскоро потоа (12, 13, 14). Ова абнормално забрзување во развојот на мозокот типично се манифестира меѓу 2 и 4-годишна возраст, следено со забавување меѓу 5-та и 16-та година (15). Во текот на брзото волуменско зголемување на мозокот видливо во раниот развој, зголемените волумени на белата и сивата маса се јавуваат и во големиот и малиот мозок споредени со контролните, иако поголеми промени се јавуваат кај белата маса (15). Најголемото зголемување на волуменот се јавува во предниот дел (челото), а најмало во задниот дел (темето) (16). |
|
|
|
Јасната неврологија за нарушувањето кај аутизмот сè уште треба да се утврди. Тоа делумно му се припишува на недостатокот на доследност меѓу наодите. Таквата непостојаност им се припишува на многубројни фактори, забележителни дијагностички и критериуми на исклучување кај контрадикторниот испитаник. Постојат статистички проблеми кај собраните податоци за аутизмот, тоа главно се должи на малиот обем на мострата, изненадувачките фактори како што се коморбидноста со други нарушувања, IQ и историјата на лекувањето. Меѓутоа, јасно е дека карактеристичните невропатологии се поврзуваат со суштинските симптоми на болеста. Посебно, пет невропатолошки карактеристики се поврзуваат со аутистичкото нарушување: зголемената тежина на мозокот и волуменот на белата маса во детството, намалениот број на невроните и зголемената густина на пакување на клетките во лимбичкиот систем на прозенцефалонот, намалениот број на Пуркиевите клетки во малиот мозок, промените во однос на возраста, на големината на клетките и бројот во јадрото на дијагоналната лента на Брока, длабоките церебеларни јадра и долната олива, како и малформациите на церебралниот кортекс и мозочното стебло (11). Овој труд дава преглед на селектирани невропатолошки студии за аутизмот и ги дискутира можностите за идно истражување кое го сугерираат нивните наоди. |
|
|
|
|
|
|
|
Невроанатомски абнормалности |
|
Neuroanatomical Abnormalities |
|
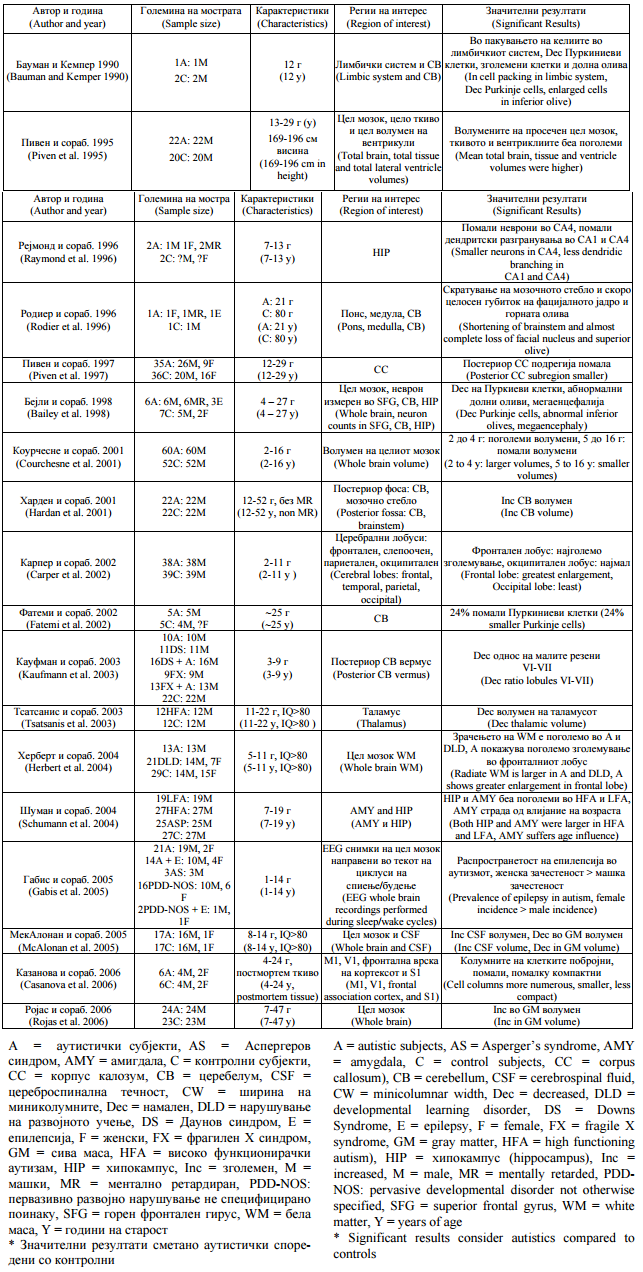
Аутистичкото нарушување го карактеризираат абнормални морфолошки карактеристики на многубројни места (табела 1). |
|
Autistic disorder is characterized by abnormal morphological features at multiple sites (Table 1). |
|
|
|
|
|
Табела 1.Невропатолошки студии на аутизам |
|
Table 1. Neuropathological studies in autism |
|
Појавата на техники за невровизуелизација како што се снимањето со магнетна резонанца со висока резолуција (МР) кое дава поголема диференцијација на ткивото и снимањето на дифузијата на тензорот (ДТС) кое ја карактеризира организацијата на белата маса, ги осветлуваат овие места кои примарно го инволвираат лимбичкиот систем и малиот мозок. Постмортемските студии откриваат малформации на неокортексот вклучувајќи атипично ориентирани пирамидални клетки, регии на зголемена густина на невронот и кортексот и неправилни ламинарни мостри (23). Неокортексните миниколумни, основните функционални единици на мозокот кои ги организираат невроните во кортексниот простор, се помали, помалку компактни и побројни кај пациентите со аутизам споредени со контролните (22, 24). Варијацијата кај аутистичките симптоми може да го рефлектира степенот до кој се заболени делови од системот. |
|
The advent of neuroimaging techniques such as high-resolution magnetic resonance (MR) imaging yielding greater tissue differentiation and diffusion tensor imaging (DTI) characterizing white matter organization has illuminated these sites, which primarily involve the limbic system and cerebellum. Postmortem studies have revealed neocortical malformations including atypically oriented pyramidal cells, areas of increased neuronal and cortical density and irregular laminar patterns (23). Neocortical minicolumns, the basic functional units of the brain that organize neurons in cortical space, are smaller, less compact and more numerous in autistic patients compared with controls (22, 24). Variation in autistic symptoms may reflect the extent to which parts of the system are affected. |
|
|
|
|
|
Кортексни и супкортексни морфолошки абнормалности |
|
Cortical and Sub-cortical Morphological Abnormalities |
|
Квантитативното структурно истражување на снимањето со МР покажува дека вкупниот волумен на CSF значително е зголемен кај пациентите со аутизам кога се споредуваат со контролните (25). Значителните разлики во регионалниот мозочен волумен на префронталните и париетално-слепоочните надворешни слоеви исто така се разработени во оваа студија. Испитаниците со аутизам покажуваат 25% просечно намалување кај сивата маса, специфично во орбиталниот, долниот и средно фронталниот гирус, опашкастото јадро, вентралниот слепоочен |
|
Quantitative structural MRI research has shown that CSF total volume is significantly increased in autistic patients when compared to controls (25). Significant differences in regional brain volume of prefrontal and parieto-temporal cortices were also reported in this study. Autistic subjects showed a 25% average reduction in gray matter, specifically in the orbital, inferior and middle frontal gyri, caudate nucleus, ventral temporal lobe and medial parietal lobe of the right hemisphere and in orbital, |
|
лобус и средниот париетален лобус на десната хемисфера и во орбиталниот, средниот и средно фронталниот гирус, средниот и горниот слепоочен гирус, опашкастото јадро и средниот париетален лобус во левата хемисфера. Насекаде, резултатите на сивата маса се контрадикторни. Регионалните волуметриски зголемувања се покажуваат во средните фронтални гири, левиот среден слепоочен или прецентрален гирус, десниот вретенаст гирус, десниот постцентрален гирус и билатералното опашкасто јадро кај аутистичките, наспроти контролните групи (26). Има постојано намалување на големината на корпус калозумот кај аутизмот, специфично кај постериорниот (задниот) дел (27). |
|
middle and medial frontal gyri, middle and superior temporal gyri, caudate nucleus and medial parietal lobe in the left hemisphere. Elsewhere, gray matter results are contradictory. Regional volumetric increases have been shown in medial frontal gyri, left middle temporal and pre-central gyri, right fusiform gyrus, right post-central gyrus, and bilateral caudate nucleus in autistic relative to control groups (26). There is a consistent reduction in corpus callosum size in autism, specifically in the posterior portion (27). |
|
Доказот за бројот на клетките на невронот и густината на пакување кај аутистичката амигдала е контрадикторен. Намалувањето на бројот на клетките на невронот и намалување на густината на пакување на клетките во средните јадра на амигдалата се забележани (29). Меѓутоа, една понова студија не открива никакви разлики во бројот на невронските клетки или густината на пакување во мозокот на пациентите со аутизам, но забележува целосно зголемување на амигдалата (35). Во студија изведена на 3-4-годишни деца, откриено е дека амигдалата е 14% поголема од левата церебрална хемисфера и 22% поголема во десната церебрална хемисфера на пациентите со аутизам споредени со контролните (36). Понатаму се покажа дека ова зголемување на обемот на амигдалата се однесува директно на аутизмот повеќе отколку на менталната ретардација (33). Слично на наодите кај хипокампусот, додека амигдалата е поголема кај малите деца со аутизам, се открива дека е слична кај возрасните кога се споредуваат со контролните (34, 37). |
|
Evidence regarding neuronal cell size and packing density in the autistic amygdale is contradictory. Reduction in neuronal cell size and increased cell packing density in medial nuclei of the amygdala was reported (29). However, a more recent study found no difference in neuronal cell number or packing density in the brains of autistic patients, but noted an overall enlargement of the amygdala (35). In a study performed on 3-4 year old children, it was discovered that the amygdala was 14% larger in the left cerebral hemisphere and 22% larger in the right cerebral hemisphere of autistic subjects compared to controls (36). Further it has been indicated that this increase in amygdala size is related directly to autism rather than mental retardation (33). Similarly to hippocampal findings, while the amygdala is larger in young children with autism, it has been found to be smaller in adults when compared to controls (34, 37). |
|
|
|
|
|
Морфолошки абнормалности на мозочното стебло |
|
Brainstem Morphological Abnormalities |
|
На бруто анатомско ниво, во една од најопширните невропатолошки студии за аутизмот, најдено е дека понсот кај пациентите со аутизам е помал отколку кај контролните субјекти, а тоа е исто така случај со медулата и средносагиталните регии на средниот мозок (40). Дополнително, понсот се развива побргу кај пациентите со аутизам споредени со контролните. Оваа зголемена стапка на растење не е набљудувана во другите регии на мозочното стебло. |
|
On a gross anatomical level, in one of the most extensive neuropathological studies on autism, it was found that the pons of autistics is smaller than in control subjects and that this is also the case with the medulla and midbrain midsagittal areas (40). Additionally, the pons developed more rapidly in autistic subjects compared with controls. This increased growth rate was not observed in other brainstem regions. |
|
Долното маслиново јадро постојано е морфолошки најабнормалната структура во мозочното стебло кај пациентите со аутизам. Интересно, аберацијата на големината се чини дека зависи од возраста. Кај деца помали од 12 години, невроните кај долната олива се зголемени и обилни кога се споредени со контролните на иста возраст, но кај возрасни постари од 21 година овие исти неврони се јавуваат мали и бледи но се присутни во споредливи бројки (41). Овие промени во однос на возраста кај долните маслиноидни неврони се најзабележливи кај маслиноидната регија која се протега на Пуркиниевите клетки во задностраничниот дел на страничните церебеларни лобуси (42). Се покажа дека невроните на маслиновото јадро се ектопични и имаат тенденција да се групираат периферно (31). Покрај тоа, намален број на неврони во фацијалното јадро и горната олива се забележани кај еден пациент со аутизам со коморбиден Мебиусов синдром како и скратување на мозочното стебло меѓу трапезоидното тело и долната олива (43). |
|
The inferior olivary nucleus is consistently the most morphologically abnormal structure in the brainstem of autistic patients. Interestingly, this size aberration appears to be age dependent. In children less than 12 years of age, neurons in the inferior olive are enlarged and abundant when compared to age-matched controls, but in adults older than 21 these same neurons appear small and pale but present in comparable numbers (41). These age-related changes in inferior olivary neurons are most evident in the olivary region that projects to Purkinje cells in the postero-lateral part of the lateral cerebellar lobes (42). It has also been shown that neurons in the olivary nucleus are ectopic and tend to cluster peripherally (31). In addition, decreased numbers of neurons in the facial nucleus and superior olive have been observed in an autistic patient with comorbid Moebius syndrome as well as a shortening of the brainstem between the trapezoid body and the inferior olive (43). |
|
|
|
|
|
Церебеларни морфолошки абнормалности |
|
Cerebellar Morphological Abnormalities |
|
Церебелумот е најпостојано место на абнормалности на невроните кај аутизмот. Изразен преку волуменот на прекршеницата, церебелумот е значително поголем кај пациентите со аутизам споредени со контролните, дури кога се исправа целиот волумен на мозокот (44). Забележани се намалена густина на Пуркиниевите клетки и намален број на Пуркиниеви клетки во церебеларните хемисфери (45), посебно во задностраничниот и кортексот на неоцеребелумот и кортексот на оригиналниот церебелум (46). При споредба на големината на Пуркиниевите клетки, откриено е дека средната големина е 24% помала кај пациентите со аутизам споредени со контролните според истата возраст и пол (47). Региите на вермис покажуваат хиперплазија и хипоплазија, иако вторава е позастапена (48). |
|
The most consistent site of neural abnormality in autism is the cerebellum. In terms of shear volume, the cerebellum is significantly larger in autistic subjects compared with controls, even when correcting for total brain volume (44). Reduced Purkinje cell density and decreased number of Purkinje cells in the cerebellar hemispheres has been reported (45), particularly in the posterolateral and neocerebellar cortex and archicerebellar cortex (46). In a comparison of Purkinje cell size, it was found that the mean size was 24% smaller in autistics compared to age and sex-matched controls (47). Cerebellar vermal regions show both hyperplasia and hypoplasia, though the latter is more prevalent (48). In a study comparing cases of autism associated with fragile X syndrome to those without this diagnosis, it was found that reductions in vermian lobules VI and VII (posterosuperior vermis) are specific to idiopathic autism and incre- |
|
идиопатски аутизам, а намалената големина на малите резени VI и VII се поврзува со аутизмот кај фрагилниот X синдром (49). Пациентите со аутизам без фрагилниот X синдром исто така покажуваат зголемување на варијабилноста на големината на малите резени и проширување на просторот меѓу листовите. Овие наоди забележуваат регионална селективност на намалување на големината на малите резени кај идиопатскиот аутизам. |
|
ased size of lobules VI and VII is associated with autism in fragile X syndrome (49). Autistic patients without fragile X syndrome also showed increased variability in lobule size and a widening of the space between folia. These findings evidence a regional selectivity of vermal size reduction in idiopathic autism. |
|
|
|
|
|
Дискусија |
|
Discussion |
|
Етиологијата на аутизмот останува енигма, но истражувањето сугерира мултифакторна етиологија (50, 51). Гледиште што преовладува е дека аутизмот е предизвикан од патофизиолошки процес кој вклучува интеракција на рана повреда од средината и генетска предиспозиција. Микроскопските абнормалности во мозокот на пациентите со аутизам сугерираат пренатален почеток на нарушувањето. За време на феталниот развиток, долните маслиновидни искачувачки влакна формираат врски на синапсата со дендритите на Пуркиниевите клетки на церебелумот во транзитната зона позната како ламина дисеканс на ~28 гестациски недели (52). Бидејќи оваа зона исчезнува по 30-тата гестациска недела, би можело губитокот на Пуркиниевите клетки забележан кај пациентите со аутизам да е предизвикан од настан што се случил пред овој временски период. Меѓутоа, промените, во однос на возраста, кај големината на невроните во јадрата на церебелумот и долната олива во текот на аутистичкиот животен век даваат доказ за активен патолошки процес што продолжува постнатално. |
|
The etiology of autism remains an enigma, but research suggests a multifactorial etiology (50, 51). The prevailing view is that autism is caused by a pathophysiological process involving the interaction of an early environmental insult and a genetic predisposition. Microscopic abnormalities in the brain of autistic patients suggest a prenatal onset of the disorder. During fetal development, inferior olivary climbing fibers form synaptic connections with cerebellar Purkinje cell dendrites in a transitory zone known as the lamina dissecans at ~28 weeks gestation (52). Because this zone disappears after 30 weeks of gestation, it could be that the Purkinje cell loss seen in autistic subjects is caused by an event that occurs before this time period. However, age-related changes in neuronal size in the cerebellar nuclei and the inferior olive during the autistic lifespan provide evidence for an active pathological process that continues postnatally. |
|
Структура и функција: морфолошки аномалии кај аутизмот и нивното бихевиорално значење |
|
Structure and function: morphologic anomalies in autism and their behavioral significance |
|
Неможноста да се комуницира, да се интерпретираат емоциите и намерите на другите и да се прави разлика меѓу нечие знаење и верувањата на другите, се одлични знаци на аутизмот. Значителните разлики во волуменот на региите на мозокот во префронталните и задните-слепоочни кортекси (надворешни слоеви) кај пациентите со аутизам можат да се причина за овие социјални и лингвистички дефицити (25). Неколку студии за функционално снимање детектираат абнормалности во активацијата на структурите на предниот и задниот лобус кај пациентите со аутизам во текот на теоријата на задачи за умот (53). |
|
An inability to communicate, interpret others’ emotions and intentions and distinguish between ones own knowledge and others’ beliefs are distinctive hallmarks of autism. Significant differences in regional brain volume in the prefrontal and parieto-temporal cortices of autistics could account for these social and linguistic deficits (25). Several functional imaging studies have detected abnormalities in the activation of frontal and temporal lobe structures in autistic patients during theory of mind tasks (53). Therefore, deviations in the normal cerebellar circuit could account for the deficiencies in sensory and motor function seen in autistic individuals (63). |
|
Затоа, девијациите во нормалниот опсег на церебелумот се сметаат за причина на недостатоците во сензорните и моторните функции кај лицата со аутизам (63). |
|
|
|
|
|
|
|
Идна дискусија |
|
Future Direction |
|
Бидејќи сфаќањето за патофизиологијата на аутизмот останува ограничено, не постои актуелно лечење на аутизмот. Додека застапеноста се чини дека значително расте, тешко е да се одреди дали тоа всушност ја одразува зголемената зачестеност во состојбата или повеќе во разликите на дијагностичката методологија. Високата коморбидност на аутизмот со други невролошки нарушувања како што се менталната ретардација, епилепсијата, Дауновиот синдром и фрагилниот X синдром го отежнуваат проучувањето на прогресијата на нарушувањето. Невропатолошките студии покажуваат промени во морфометријата и организацијата на миниколумните и другите кругови на невроните. Еволуцијата на методологиите за снимање открива изменети мостри на поврзување во и меѓу региите на кортексот и субкортексот. Овие наоди имаат импликации врз сфаќањето за аутизмот во смисла на менување на хиерархиската обработка на информации. Лонгитудиналните студии кај голема популација на пациенти ќе има поголема статистичка моќ и ќе обезбеди анализа на кохорти со специфични ендофенотипови или субдијагностички карактеристики. Целта на идните невропатолошки студии е дека промените кај невропсихолошките мостри на поврзување можат да се однесуваат и на клучните карактеристики на аутизмот во изолација и во контекст на коморбидните состојби. |
|
As understanding of the pathophysiology of autism remains limited, there is no current cure for autism. While prevalence appears to be increasing significantly, it is difficult to determine whether this actually reflects an increased frequency in the condition or rather differences in diagnostic methodology. The high comorbidity of autism with other neurological disorders such as mental retardation, epilepsy, Down syndrome and fragile X syndrome makes it difficult to study the progression of this disorder. Neuropathological studies have shown changes in the morphometry and organization of minicolumns and other neuronal circuits. The evolution of imaging methodologies is revealing altered patterns of connectivity within and between cortical and subcortical areas. These findings have implications for understanding autism as resulting from an alteration within the hierarchical organization of the cortex. Longitudinal studies of large patient populations will have greater statistical power and provide for analysis of cohorts with specific endophenotypes or subdiagnostic features. One aim of future neuropathological studies is that changes in neurophysiological patterns of connectivity can be related both to core features of autism in isolation and in the context of co-morbid conditions. |
|
Втората цел на идните невропатолошки студии е да се направи корелација на наводните наоди со оние кои произлегуваат од алтернативните методи ( на пр. генетски и биохемиски студии) користејќи исти примероци или пациентска популација. Интегративниот метод е најприкладен за да се обезбеди сингеризам и идни увиди во оваа деструктивна, невропсихијатриска состојба. |
|
|
|
|
|
|
Share Us
Journal metrics
-
 SNIP 0.059
SNIP 0.059 -
 IPP 0.07
IPP 0.07 -
 SJR 0.13
SJR 0.13 -
 h5-index 7
h5-index 7 -
 Google-based impact factor: 0.68
Google-based impact factor: 0.68
10 Most Read Articles
- PARENTAL ACCEPTANCE / REJECTION AND EMOTIONAL INTELLIGENCE AMONG ADOLESCENTS WITH AND WITHOUT DELINQUENT BEHAVIOR
- RELATIONSHIP BETWEEN LIFE BUILDING SKILLS AND SOCIAL ADJUSTMENT OF STUDENTS WITH HEARING IMPAIRMENT: IMPLICATIONS FOR COUNSELING
- EXPERIENCES FROM THE EDUCATIONAL SYSTEM – NARRATIVES OF PARENTS WITH CHILDREN WITH DISABILITIES IN CROATIA
- INOVATIONS IN THERAPY OF AUTISM
- AUTISM AND TUBEROUS SCLEROSIS
- THE DURATION AND PHASES OF QUALITATIVE RESEARCH
- REHABILITATION OF PERSONS WITH CEREBRAL PALSY
- DISORDERED ATTENTION AS NEUROPSYCHOLOGICAL COGNITIVE DISFUNCTION
- DIAGNOSTIC AND TREATMENT OPTIONS IN AUTISTIC SPECTRUM DISORDERS – AN OVERVIEW
- HYPERACTIVE CHILD`S DISTURBED ATTENTION AS THE MOST COMMON CAUSE FOR LIGHT FORMS OF MENTAL DEFICIENCY
















